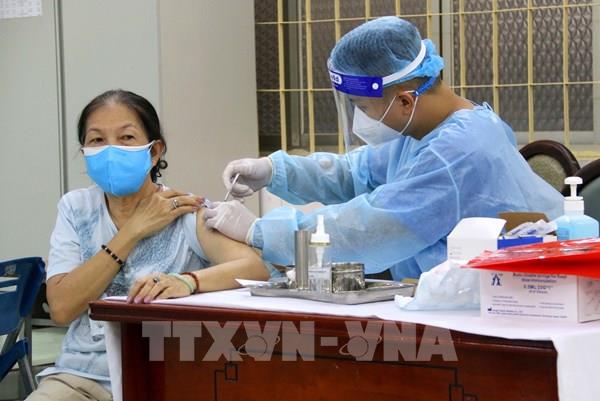
Cho phép thử nghiệm lâm sàng Nano Covax giai đoạn 3 liều 25mcg
Ngày 7/8, đã diễn ra cuộc họp trực tuyến khẩn của Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn 1 vaccine COVID-19 "made in Vietnam" Nano Covax và thông qua đánh giá giữa kỳ giai đoạn 2 của vaccine này.
Tại điểm cầu Bộ Y tế, Giáo sư, Tiến sĩ Trương Việt Dũng, Chủ tịch Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia chủ trì cuộc họp. Các thành viên của Hội đồng đạo đức đã nghe đại diện Học viện Quân Y – đơn vị đang thực hiện thử nghiệm lâm sàng đại diện cho các đơn vị thử nghiệm báo cáo kết quả thử nghiệm lâm sàng giai đoạn 1 vaccine Nano Covax cũng như báo cáo đánh giá giữa kỳ giai đoạn 2. Hội đồng đã thống nhất nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn 1 vaccine Nano Covax với dữ liệu theo dõi đến tháng thứ 6 kể từ liều tiêm đầu tiên của giai đoạn 1 trên 60 người tình nguyện với 3 mức liều 25 mcg, 50 mcg, 75 mcg. Trên cơ sở cập nhật kết quả đánh giá giữa kỳ giai đoạn 2 đến thời điểm hiện tại, Hội đồng quyết định tiếp tục cho phép triển khai thử nghiệm lâm sàng giai đoạn 3 với mức liều 25mcg theo đề cương nghiên cứu đã được phê duyệt. Phát biểu tại cuộc họp Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia, Thứ trưởng Bộ Y tế Trần Văn Thuấn - Tổ trưởng Tổ công tác đặc biệt về nghiên cứu thử nghiệm lâm sàng, phát triển vaccine phòng COVID-19 nhấn mạnh, dịch bệnh diễn biến phức tạp, chiến lược vaccine đóng vai trò chủ chốt trong công tác phòng chống dịch. Cảm ơn Hội đồng đã cho phép dự thính cuộc họp, Thứ trưởng Bộ Y tế đánh giá, đây là cuộc họp hết sức khẩn trương, nghiêm túc, thể hiện rõ sự ủng hộ, quyết tâm, quyết liệt của Bộ Y tế đối với việc nghiên cứu phát triển vắc xin phòng chống COVID-19 trong nước.“Chúng ta khẩn trương nhưng cần phải khoa học, chặt chẽ để đảm bảo số liệu đưa ra đủ tin cậy”. Thứ trưởng Bộ Y tế cho biết.
Đồng thời khẳng định, Bộ Y tế đồng tình với ý kiến của Chủ tịch Hội đồng về việc cần thành lập ngay tổ hỗ trợ, phân tích, đánh giá, giám sát số liệu và quy trình của 2 đơn vị tham gia nghiên cứu thử nghiệm lâm sàng và phải có báo cáo trước ngày 14/8/2021. Thứ trưởng Trần Văn Thuấn cũng đề nghị các đơn vị nhận thử như Học viện Quân y, Viện Pasteur Thành phố Hồ Chí Minh và đơn vị độc lập là Viện Vệ sinh dịch tễ Trung ương kết hợp với nhà sản xuất là Công ty Cổ phần công nghệ sinh học dược Nanogen: sau khi Hội đồng đã cho phép nghiệm thu kết quả giai đoạn 1 và giữa kỳ giai đoạn 2 phải khẩn trương hoàn thiện, đồng thời chuẩn bị ngay và gửi cho Hội đồng và Cục Khoa học Công nghệ và Đào tạo báo cáo pha 3a, gửi càng sớm càng tốt, ngay đầu tuần tới. Trên cơ sở đó, kết hợp với kết quả của Tổ công tác, Thứ trưởng Bộ Y tế đề nghị Hội đồng tiếp tục họp vào ngày 15/8/2021 để đánh giá kết quả giai đoạn 3a. Dựa trên kết quả đánh giá, đề nghị các thầy cô trong Hội đồng khuyến nghị các biện pháp khẩn thiết, cần thiết, hợp lý. “Tại cuôc họp hôm nay, với đầy đủ các cơ quan nghiên cứu, Bộ Y tế đề nghị cân nhắc xem xét có tiến hành thêm 1 nghiên cứu bổ sung về việc tiêm mũi 3 vaccine Nano Covax hay không, bên cạnh đó xem xét bổ sung các chủng mới của virus Corona (như chủng Delta) vào nghiên cứu ở thời điểm thích hợp”, Thứ trưởng Bộ Y tế nói. Cũng tại cuộc họp, Thứ trưởng Trần Văn Thuấn đề nghị Cục Khoa học Công nghệ và Đào tạo có công văn trả lời các tỉnh có công văn gửi Chính phủ, Bộ Y tế xin phép tiêm thử vaccine Nano Covax. "Trong đó thể hiện rõ quan điểm của Bộ Y tế rất ủng hộ, tạo mọi điều kiện để các tỉnh tham gia thử nghiệm lâm sàng, tuy nhiên phải tuân thủ đúng theo các quy trình, quy định về thử nghiệm lâm sàng. Bộ Y tế rất không đồng ý việc lợi dụng ưu tiên thử nghiệm lâm sàng vào mục đích thương mại", Thứ trưởng Trần Văn Thuấn nhấn mạnh./.Tin liên quan
-
![Tiêm vaccine COVID-19 giúp giảm tỷ lệ tử vong như thế nào so với không tiêm?]() Kinh tế & Xã hội
Kinh tế & Xã hội
Tiêm vaccine COVID-19 giúp giảm tỷ lệ tử vong như thế nào so với không tiêm?
09:10' - 07/08/2021
Ngay cả khi đã tiêm chủng mà vẫn nhiễm SARS-CoV-2, thì lợi ích mà mũi vaccine mang lại vẫn là rất quan trọng với cá nhân người tiêm và cộng đồng.
-
![CDC Mỹ: Người chưa tiêm vaccine COVID-19 có nguy cơ tái nhiễm cao gấp đôi]() Kinh tế & Xã hội
Kinh tế & Xã hội
CDC Mỹ: Người chưa tiêm vaccine COVID-19 có nguy cơ tái nhiễm cao gấp đôi
08:53' - 07/08/2021
Theo nghiên cứu của CDC Mỹ, những người không được tiêm chủng vaccine ngừa COVID-19 có nguy cơ tái nhiễm virus SARS-CoV-2 cao hơn gấp hai lần so với những người được tiêm chủng đầy đủ.
-
![Ngày 7/8, thêm 3.794 ca mắc mới COVID-19, hơn 8,5 triệu liều vaccine đã được tiêm]() Kinh tế & Xã hội
Kinh tế & Xã hội
Ngày 7/8, thêm 3.794 ca mắc mới COVID-19, hơn 8,5 triệu liều vaccine đã được tiêm
06:43' - 07/08/2021
Theo bản tin của Bộ Y tế, tính từ 18h30 ngày 6/8 đến 6h ngày 7/8 trên Hệ thống Quốc gia quản lý ca bệnh COVID-19 ghi nhận 3.794 ca mắc trong nước
-
![Trưởng đại diện WHO tại Việt Nam: Hãy tiêm bất kỳ loại vaccine có sẵn khi đến lượt bạn]() Ý kiến và Bình luận
Ý kiến và Bình luận
Trưởng đại diện WHO tại Việt Nam: Hãy tiêm bất kỳ loại vaccine có sẵn khi đến lượt bạn
21:57' - 06/08/2021
Các vaccine đều có hiệu quả rất cao trong việc ngăn ngừa mắc bệnh nặng cần nhập viện do COVID-19 gây ra.
-
![Bộ Y tế yêu cầu đẩy nhanh tiến độ tiêm vaccine phòng COVID-19]() Kinh tế & Xã hội
Kinh tế & Xã hội
Bộ Y tế yêu cầu đẩy nhanh tiến độ tiêm vaccine phòng COVID-19
19:32' - 06/08/2021
Hiện nay vẫn còn một số đơn vị rất chậm trễ trong việc tiếp nhận vaccine, tổ chức triển khai tiêm chủng và báo cáo tiến độ.
Tin cùng chuyên mục
-
![Hà Nội, TP. Hồ Chí Minh và một số tỉnh phía Bắc ô nhiễm không khí ở mức xấu và kém]() Kinh tế & Xã hội
Kinh tế & Xã hội
Hà Nội, TP. Hồ Chí Minh và một số tỉnh phía Bắc ô nhiễm không khí ở mức xấu và kém
09:19'
Trước tình hình ô nhiễm không khí nghiêm trọng tại các tỉnh, thành phố, Bộ Nông nghiệp và Môi trường sẽ phối hợp với các địa phương xây dựng quy trình ứng phó khẩn cấp ô nhiễm không khí.
-
![Lịch thi đấu vòng 26 ngoại hạng Anh Premier League mùa giải 2025-2026]() Kinh tế & Xã hội
Kinh tế & Xã hội
Lịch thi đấu vòng 26 ngoại hạng Anh Premier League mùa giải 2025-2026
09:15'
Bnews. Lịch thi đấu ngoại hạng Anh Premier League hôm nay, lịch thi đấu vòng 26 ngoại hạng Anh Premier League, Lịch thi đấu ngoại hạng Anh mùa giải 2025-2026.
-
![Lịch tạm ngừng cấp điện Quảng Ngãi ngày mai 11/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
Lịch tạm ngừng cấp điện Quảng Ngãi ngày mai 11/2
09:14'
BNEWS. Lịch cắt điện cập nhật mới nhất các phường, xã tại tỉnh Quảng Ngãi ngày mai 11/2. Lịch tạm ngừng cấp điện Quảng Ngãi. Lịch tạm ngừng cấp điện Quảng Ngãi hôm nay.
-
![Lịch thi đấu bóng đá hôm nay ngày 10/2/2026]() Kinh tế & Xã hội
Kinh tế & Xã hội
Lịch thi đấu bóng đá hôm nay ngày 10/2/2026
08:46'
Bnews. Lịch thi đấu bóng đá hôm nay 10/2, sáng mai 11/2 các trận đấu trong nước, quốc tế đêm nay và sáng mai được cập nhật mới nhất, chính xác nhất. Lịch thi đấu ngoại hạng Anh, La Liga, Bundesliga.
-
![Hà Nội tổ chức lại giao thông hầm chui Kim Đồng – Giải Phóng]() Kinh tế & Xã hội
Kinh tế & Xã hội
Hà Nội tổ chức lại giao thông hầm chui Kim Đồng – Giải Phóng
07:45'
Từ ngày 10/2 đến ngày 31/3, các phương tiện tham gia giao thông đường bộ đi theo hai chiều dưới hầm chui Kim Đồng - Giải Phóng theo hướng đường Kim Đồng đi khu đô thị Định Công và ngược lại.
-
![VPI và PVChem tổ chức chương trình an sinh xã hội “Áo ấm vùng cao” và “Tết vì người nghèo”]() Kinh tế & Xã hội
Kinh tế & Xã hội
VPI và PVChem tổ chức chương trình an sinh xã hội “Áo ấm vùng cao” và “Tết vì người nghèo”
07:44'
VPI và PVChem vừa phối hợp với Đoàn Thanh niên tỉnh Lai Châu tổ chức chương trình an sinh xã hội “Áo ấm vùng cao” và “Tết vì người nghèo” năm 2026 tại xã biên giới Sì Lở Lầu, tỉnh Lai Châu.
-
![XSMN 10/2. Kết quả xổ số miền Nam hôm nay ngày 10/2/2026. XSMN thứ Ba ngày 10/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSMN 10/2. Kết quả xổ số miền Nam hôm nay ngày 10/2/2026. XSMN thứ Ba ngày 10/2
19:30' - 09/02/2026
XSMN 10/2. KQXSMN 10/2/2026. Kết quả xổ số hôm nay ngày 10/2. XSMN thứ Ba. Xổ số miền Nam hôm nay 10/2/2026. Trực tiếp KQXSMN ngày 10/2. Kết quả xổ số miền Nam hôm nay thứ Ba ngày 10/2/2026.
-
![XSMT 10/2. Kết quả xổ số miền Trung hôm nay ngày 10/2/2026. XSMT thứ Ba ngày 10/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSMT 10/2. Kết quả xổ số miền Trung hôm nay ngày 10/2/2026. XSMT thứ Ba ngày 10/2
19:30' - 09/02/2026
Bnews. XSMT 10/2. Kết quả xổ số hôm nay ngày 10/2. XSMT thứ Ba. Trực tiếp KQXSMT ngày 10/2. Kết quả xổ số miền Trung hôm nay thứ Ba ngày 10/2/2026.
-
![Kết quả Vietlott Power 6/55 ngày 10/2 - Kết quả xổ số Vietlott ngày 10/2/2026 - Xổ số Vietlott Power 6/55 hôm nay]() Kinh tế & Xã hội
Kinh tế & Xã hội
Kết quả Vietlott Power 6/55 ngày 10/2 - Kết quả xổ số Vietlott ngày 10/2/2026 - Xổ số Vietlott Power 6/55 hôm nay
19:30' - 09/02/2026
Bnews. Kết quả Vietlott Power 6/55 ngày 10/2. Kết quả xổ số Vietlott hôm nay ngày 10 tháng 2 năm 2026 - Xổ số Vietlott Power 6/55 hôm nay.


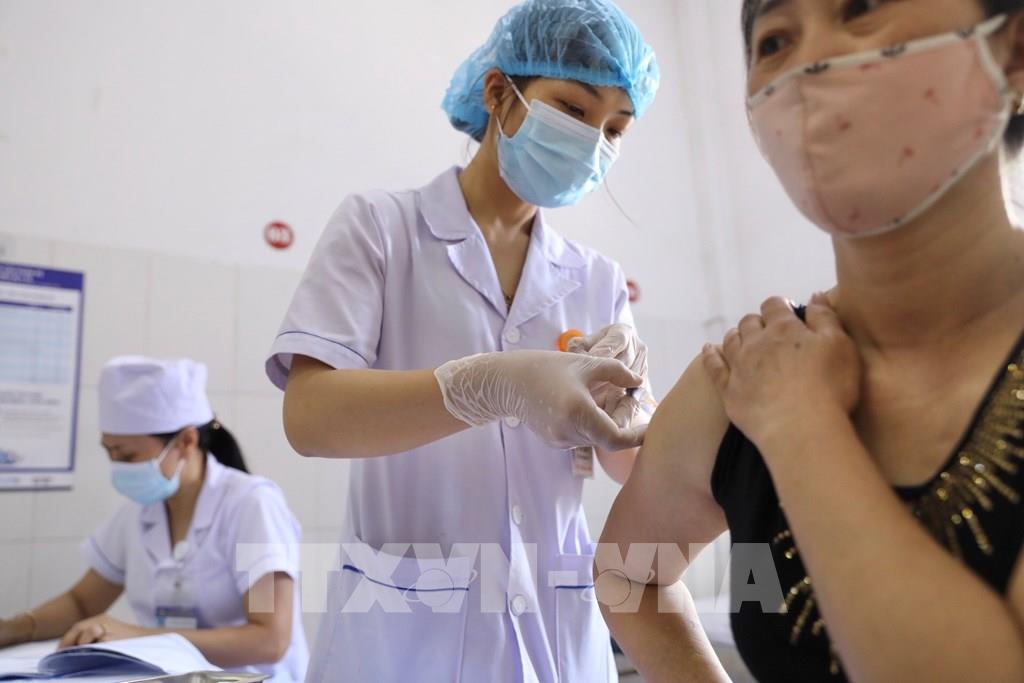 Nhân viên y tế tiêm thử nghiệm vaccine Nano Covax cho tình nguyện viên tại huyện Văn Lâm. Ảnh: Minh Quyết - TTXVN
Nhân viên y tế tiêm thử nghiệm vaccine Nano Covax cho tình nguyện viên tại huyện Văn Lâm. Ảnh: Minh Quyết - TTXVN