FDA của Mỹ cấp phép sử dụng khẩn cấp thuốc điều trị bằng kháng thể
Ngày 9/11, Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đã cấp phép sử dụng khẩn cấp loại thuốc điều trị bệnh viêm đường hô hấp cấp COVID-19 bằng kháng thể có tên Bamlanivimab (LY-CoV555) do công ty Eli Lilly phát triển, sau khi thuốc này được chứng minh được hiệu quả điều trị đối với bệnh nhân ngoại trú, qua đó giảm đáng kể nguy cơ bệnh nhân phải nhập viện.
Theo đó, thuốc Bamlanivimab 700mg được cấp phép điều trị cho những bệnh nhân mắc COVID-19 ở thể nhẹ đến thể trung bình ở cả người lớn và trẻ em từ 12 tuổi trở lên và có nguy cơ bệnh trở nặng. Các chuyên gia của FDA nêu rõ quyết định này được đưa ra dựa trên một thử nghiệm lâm sàng giai đoạn hai đối với các bệnh nhân ngoại trú mắc COVID-19 từ thể nhẹ đến vừa.
Sau khi được điều trị loại thuốc này qua đường tĩnh mạch, lượng virus SARS-CoV-2 trong cơ thể các bệnh nhân này cũng như các triệu chứng đã giảm rõ rệt.
Ngoài ra, các dữ liệu cũng cho thấy trong số các bệnh nhân nguy cơ cao mắc bệnh nặng, chỉ 3% bệnh nhân được điều trị bằng Bamlanivimab phải nhập viện so với tỷ lệ 10% người sử dụng giả dược.
Đây cũng là bằng chứng quan trọng nhất về việc thuốc Bamlanivimab có thể phát huy hiệu quả trong việc điều trị bệnh COVID-19.
Tần suất xuất hiện và các tác dụng phụ giữa Bamlanivimab và giả dược tương đương nhau, phần lớn ở mức độ nhẹ đến trung bình, với các biểu hiện như tiêu chảy, chóng mặt, nhức đầu, gây ngứa ngáy và nôn mửa.
Tuy nhiên, FDA lưu ý rằng Bamlanivimab không được phép sử dụng cho những bệnh nhân đã nhập viện vì thuốc không có tác dụng đối với những bệnh nhân trong giai đoạn cuối của bệnh.
Vào thời điểm này, hệ thống miễn dịch của cơ thể đã hoạt động quá mức và làm tổn thương các cơ quan nội tạng. Do đó, việc sử dụng thuốc quá muộn có thể dẫn đến hậu quả tồi tệ hơn.
Bamlanivimab được biết đến là thuốc sử dụng kháng thể đơn dòng, một nhóm thuốc tương đối mới được biết đến nhiều nhất trong việc điều trị một số loại ung thư và bệnh tự miễn.
Kháng thể đơn dòng là các protein được tạo ra trong phòng thí nghiệm có thể bắt chước khả năng của hệ miễn dịch phát hiện và chống lại một số protein đặc trưng, được gọi là kháng nguyên, vốn được virus và vi khuẩn gây bệnh tạo ra.
Bamlanivimab có khả năng chống lại protein đột biến của virus SARS-CoV-2 và có thể ngăn chặn virus gắn kết và xâm nhập vào tế bào người.
Tháng 8 vừa qua, Eli Lilly bắt đầu thử nghiệm Bamlanivimab và hướng tới mục tiêu thu hút được 10.000 bệnh nhân, chủ yếu là tại Mỹ, tham gia cuộc thử nghiệm.
Hãng cũng thử nghiệm loại thuốc này trong các viện dưỡng lão để xem liệu nó có thể giúp nhân viên và những người sống trong đó tránh được nguy cơ mắc bệnh hay không.
Ngày 7/10 vừa qua, Eli Lilly thông báo đã nộp đơn xin cấp phép Quyền Sử dụng khẩn cấp (EUA) đối với thuốc Bamlanivimab cho các bệnh nhân COVID-19 thể nhẹ và vừa sau khi các kết quả thử nghiệm ban đầu cho thấy tính khả quan.
* Trong diễn biến khác, cùng ngày, Cơ quan Giám sát dịch tễ quốc gia Brazil (Anvisa) đã quyết định tạm dừng chương trình thử nghiệm lâm sang giai đoạn 3 tại nước này đối với loại vaccine ngừa COVID-19 CoronaVac do hãng dược phẩm Sinovac của Trung Quốc nghiên cứu và phát triển sau khi được thông báo về một trường hợp gặp phải “tác dụng phụ nghiêm trọng”.
Phóng viên TTXVN tại Nam Mỹ dẫn thông báo của Anvisa cho biết tạm thời dừng tiêm loại vaccine này cho các tình nguyện viên mới trong số 9.000 người được lựa chọn cho chương trình này. Cơ quan chức năng sẽ tiến hành đánh giá các dữ liệu đến thời điểm này để đưa ra kết luận về việc có nên tiếp tục kế hoạch hay không. Tuy nhiên, Anvisa từ chối tiết lộ chi tiết về sự cố trên và chỉ giải thích rằng “tác dụng phụ nghiêm trọng”.
Hiện vaccine CoronaVac đang được thử nghiệm giai đoạn 3 tại Brazil, Thổ Nhĩ Kỳ, Bangladesh, Indonesia và Trung Quốc, song thông tin của Anvisa không cho biết sự cố trên xảy ra ở đâu./.
Tin liên quan
-
![Mỹ cho phép dùng thuốc remdesivir trong điều trị COVID-19]() Kinh tế & Xã hội
Kinh tế & Xã hội
Mỹ cho phép dùng thuốc remdesivir trong điều trị COVID-19
08:03' - 23/10/2020
Thông báo của Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) ngày 22/10 cho biết cơ quan này đã cấp phép sử dụng thuốc remdesivir (biệt dược Veklury) trong điều trị bệnh nhân COVID-19.
-
![Thêm nguồn thuốc điều trị COVID-19 hứa hẹn kết quả khả quan]() Đời sống
Đời sống
Thêm nguồn thuốc điều trị COVID-19 hứa hẹn kết quả khả quan
15:17' - 12/10/2020
Theo các nhà khoa học Hong Kong, RBC là loại thuốc giá rẻ, được sử dụng an toàn và hiệu quả trong điều trị viêm loét dạ dày trong hàng thập kỷ qua.
-
![Mỹ sẽ chi 486 triệu USD mua thuốc điều trị COVID-19 của AstraZeneca]() Kinh tế Thế giới
Kinh tế Thế giới
Mỹ sẽ chi 486 triệu USD mua thuốc điều trị COVID-19 của AstraZeneca
17:35' - 10/10/2020
AstraZeneca cho biết có kế hoạch cung cấp tới 100.000 liều thuốc như trên bắt đầu từ cuối năm 2020 và Chính phủ Mỹ có thể mua thêm 1 triệu liều thuốc trên vào năm 2021 theo một thỏa thuận riêng.
Tin cùng chuyên mục
-
![Tai nạn tàu hỏa chở 250 người ở Mexico]() Kinh tế & Xã hội
Kinh tế & Xã hội
Tai nạn tàu hỏa chở 250 người ở Mexico
07:45'
Ngày 28/12, một đoàn tàu chở chở 250 người đã bị trật bánh trên cầu gần thị trấn Nizanda thuộc bang Oaxaca, miền đông nam Mexico, khiến ít nhất 20 người bị thương và nhiều hành khách bị mắc kẹt.
-
![Bão mùa đông quét Israel, nguy cơ lũ lụt gia tăng]() Kinh tế & Xã hội
Kinh tế & Xã hội
Bão mùa đông quét Israel, nguy cơ lũ lụt gia tăng
07:00'
Một cơn bão mùa đông mạnh đang ảnh hưởng nghiêm trọng tới Israel, gây mưa lớn, gió mạnh và tuyết rơi, làm gia tăng nguy cơ ngập lụt, lũ quét tại nhiều khu vực, đặc biệt ở miền Nam và ven Biển Chết.
-
![Lịch thi đấu bóng đá hôm nay ngày 29/12/2025]() Kinh tế & Xã hội
Kinh tế & Xã hội
Lịch thi đấu bóng đá hôm nay ngày 29/12/2025
05:00'
Bnews. Lịch thi đấu bóng đá hôm nay 29/12, sáng mai 30/12 các trận đấu trong nước, quốc tế đêm nay và sáng mai được cập nhật mới nhất, chính xác nhất. Lịch thi đấu ngoại hạng Anh, La Liga, Bundesliga.
-
![Khai mạc Liên hoan ẩm thực du lịch Ninh Bình năm 2025]() Kinh tế & Xã hội
Kinh tế & Xã hội
Khai mạc Liên hoan ẩm thực du lịch Ninh Bình năm 2025
22:08' - 28/12/2025
Tối 28/12, UBND tỉnh Ninh Bình tổ chức khai mạc Liên hoan ẩm thực du lịch Ninh Bình năm 2025 với chủ đề “Tinh hoa ẩm thực miền Cố đô”.
-
![Đức hỗ trợ cung cấp thiết bị lọc nước cho nạn nhân lũ lụt ở Việt Nam]() Kinh tế & Xã hội
Kinh tế & Xã hội
Đức hỗ trợ cung cấp thiết bị lọc nước cho nạn nhân lũ lụt ở Việt Nam
21:53' - 28/12/2025
Chia sẻ với các nạn nhân lũ lụt ở Việt Nam, Văn phòng Hợp tác Phát triển Berlin (Đức) đã tài trợ kinh phí để cung cấp nước sạch lâu dài cho ít nhất 8.000 học sinh, giáo viên và gia đình bị ảnh hưởng.
-
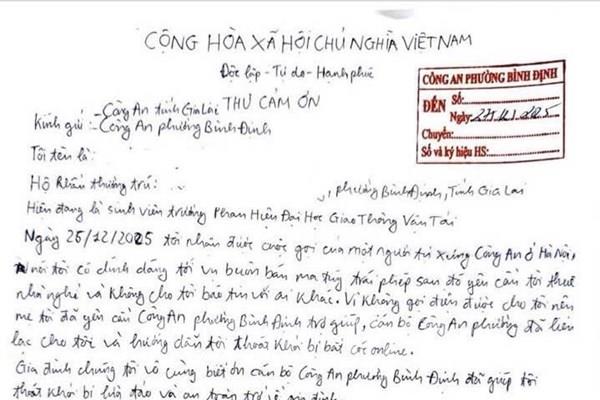
![Công an kịp thời giải cứu sinh viên bị “bắt cóc online”]() Kinh tế & Xã hội
Kinh tế & Xã hội
Công an kịp thời giải cứu sinh viên bị “bắt cóc online”
21:27' - 28/12/2025
Ngày 28/12, Công an phường Bình Định (Gia Lai) kịp thời ngăn chặn 1 vụ lừa đảo trên không gian mạng, giải cứu an toàn 1 sinh viên bị các đối tượng xấu thao túng tâm lý bằng thủ đoạn “bắt cóc online”.
-
![Hà Nội thăm hỏi nạn nhân vụ lật xe khách ở Lào Cai]() Kinh tế & Xã hội
Kinh tế & Xã hội
Hà Nội thăm hỏi nạn nhân vụ lật xe khách ở Lào Cai
21:20' - 28/12/2025
Chiều 28/12, tại Bệnh viện Hữu nghị Việt Đức, Chủ tịch Ủy ban MTTQ Việt Nam thành phố Hà Nội Bùi Huyền Mai đã thăm hỏi, động viên 7 nạn nhân trong vụ lật xe khách đi thiện nguyện ở Lào Cai.
-
![Tiếp nhận hàng viện trợ từ Ba Lan cho người dân bị thiên tai tỉnh Đắk Lắk]() Kinh tế & Xã hội
Kinh tế & Xã hội
Tiếp nhận hàng viện trợ từ Ba Lan cho người dân bị thiên tai tỉnh Đắk Lắk
20:35' - 28/12/2025
Cục Quản lý đê điều và Phòng, chống thiên tai đã tiếp nhận 7 tấn hàng viện trợ nhân đạo của Chính phủ Ba Lan tại sân bay Nội Bài, hỗ trợ người dân tỉnh Đắk Lắk khắc phục hậu quả thiên tai.
-
![Đắk Lắk: Bàn giao 5 căn nhà đầu tiên trong Chiến dịch “Thần tốc Quang Trung”]() Kinh tế & Xã hội
Kinh tế & Xã hội
Đắk Lắk: Bàn giao 5 căn nhà đầu tiên trong Chiến dịch “Thần tốc Quang Trung”
20:31' - 28/12/2025
Chiều 28/12, Sư đoàn 10, Quân đoàn 34 (Bộ Quốc phòng) tổ chức bàn giao 5 căn nhà đầu tiên trong Chiến dịch “Thần tốc Quang Trung” cho 5 hộ dân tại thôn Trung Hòa, xã Sơn Hòa, tỉnh Đắk Lắk.