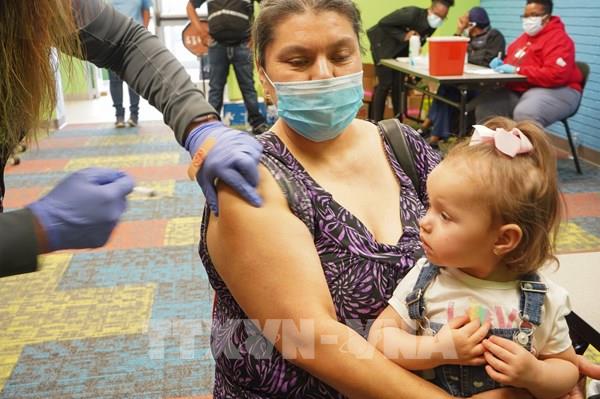
Vaccine của Pfizer/BioNTech và Moderna giúp giảm nguy cơ nhập viện vì COVID-19 ở người trên 65 tuổi
Trung tâm phòng và kiểm soát dịch bệnh (CDC) của Mỹ cho biết 2 loại vaccine sử dụng công nghệ mRNA ngừa COVID-19 được phê duyệt sử dụng khẩn cấp tại Mỹ, do các công ty Pfizer/BioNTech và Moderna phát triển, giúp giảm nguy cơ phải nhập viện liên quan đến COVID-19 đối với người từ 65 tuổi trở lên.
Theo một nghiên cứu của CDC Mỹ công bố ngày 28/4, đối với người từ 65 tuổi trở lên "đã tiêm chủng đầy đủ" ngừa COVID-19, nguy cơ phải nhập viện liên quan đến bệnh dịch này ít hơn 94% so với người cùng tuổi chưa tiêm vaccine.
Người từ 65 tuổi trở lên "đã được tiêm chủng một phần" cũng giảm 64% nguy cơ nhập viện so với những người chưa được tiêm.
CDC Mỹ định nghĩa "tiêm chủng một phần" là 2 tuần kể từ khi tiêm liều vaccine thứ nhất và "tiêm chủng đầy đủ" là 2 tuần sau khi tiêm liều thứ hai.
Đánh giá của CDC Mỹ dựa trên nghiên cứu việc nhập viện của 417 người tại 2 mạng lưới bệnh viện gồm 24 bệnh viện ở 14 bang của Mỹ.
Theo cơ quan này, đây là phát hiện đầu tiên trong thực tế tại Mỹ xác nhận các dữ liệu trong thử nghiệm lâm sàng chứng tỏ các vaccine sử dụng công nghệ mRNA giúp ngăn bệnh COVID-19 thể nặng.
Giám đốc CDC, bà Rochelle Walensky cho rằng đây là kết quả đầy hứa hẹn đối với các cộng đồng dân cư và bệnh viện của Mỹ.
Theo đó, khi các nỗ lực tiêm phòng tiếp tục được tăng cường, các hệ thống chăm sóc y tế sẽ không bị quá tải, nhờ đó sẽ có thêm nhân viên y tế và giường bệnh để phục vụ các bệnh nhân khác".
CDC kêu gọi người Mỹ từ 16 tuổi trở lên nhanh chóng đi tiêm phòng COVID-19.
Liên quan vaccine ngừa COVID-19, hãng dược BioNTech của Đức dự kiến đến tháng 9 tới sẽ có kết quả thử nghiệm vaccine ở trẻ nhỏ từ 6 tháng tuổi.
Trả lời phỏng vấn của nhật báo Der Spiegel (Đức), Giám đốc điều hành (CEO) của BioNTech, ông Ugur Sahin cho biết: "Từ tháng 7 sẽ có kết quả sơ bộ thử nghiệm đối với trẻ từ 5-12 tuổi, và tháng 9 sẽ có kết quả ở lứa tuổi nhỏ hơn".
Theo ông, việc đánh giá các dữ liệu cần trung bình từ 4-6 tuần và nếu mọi chuyện suôn sẻ, "ngay khi các dữ liệu được đánh giá, chúng tôi sẽ có thể trình lên cơ quan quản lý dược phẩm châu Âu (EMA) phê duyệt sử dụng vaccine cho trẻ em thuộc các nhóm tuổi trên".
Trước đó, trong tháng này, vaccine của Pfizer/BioNTech đã đề nghị cơ quan quản lý của Mỹ phê duyệt sử dụng khẩn cấp đối với thiếu niên từ 12-15 tuổi.
Theo ông Sahin, hiện công ty đang trong giai đoạn cuối trước khi trình các nhà quản lý châu Âu phê duyệt sử dụng cho trẻ từ 12 tuổi trở lên.
Hiện vaccine của Pfizer/BioNTech đã được phê duyệt sử dụng cho người từ 16 tuổi trở lên./.
- Từ khóa :
- covid 19
- vaccine ngừa covid 19
- Pfizer
- Moderna
- mỹ
Tin liên quan
-
![Doanh thu từ vaccine COVID-19 của Moderna được dự báo tăng lên 19,2 tỷ USD]() Chuyển động DN
Chuyển động DN
Doanh thu từ vaccine COVID-19 của Moderna được dự báo tăng lên 19,2 tỷ USD
21:31' - 06/05/2021
Hãng dược phẩm Moderna Inc (Mỹ) ngày 6/5 đã nâng dự báo doanh thu từ vaccine ngừa COVID-19 trong năm 2021 thêm 4,3% lên 19,2 tỷ USD.
-
![Đại hội Vaccine toàn cầu: Vaccine COVID-19 Moderna có hiệu quả cao nhất]() Ý kiến và Bình luận
Ý kiến và Bình luận
Đại hội Vaccine toàn cầu: Vaccine COVID-19 Moderna có hiệu quả cao nhất
18:47' - 06/05/2021
Đại hội Vaccine toàn cầu ngày 6/5 đã công nhận vaccine của Moderna (Mỹ) là loại chế phẩm cho hiệu quả tốt nhất thế giới hiện nay trong công tác phòng ngừa bệnh viêm đường hô hấp cấp COVID-19.
-
![Muôn hình vạn trạng cách khuyến khích người dân tiêm vaccine ngừa COVID-19 tại Mỹ]() Kinh tế & Xã hội
Kinh tế & Xã hội
Muôn hình vạn trạng cách khuyến khích người dân tiêm vaccine ngừa COVID-19 tại Mỹ
14:54' - 06/05/2021
Miễn phí bia, bánh, vé xem bóng rổ hay tặng trái phiếu... là biện pháp mà giới chức Mỹ cùng nhiều công ty đang phối hợp thực hiện để khuyến khích người dân Mỹ đi tiêm chủng vaccine ngừa bệnh COVID-19.
Tin cùng chuyên mục
-
![XSMB 3/2. Kết quả xổ số miền Bắc hôm nay ngày 3/2/2026. XSMB thứ Ba ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSMB 3/2. Kết quả xổ số miền Bắc hôm nay ngày 3/2/2026. XSMB thứ Ba ngày 3/2
21:36'
Bnews. XSMB 3/2. Kết quả xổ số hôm nay ngày 3/2. XSMB thứ Ba. Trực tiếp KQXSMB ngày 3/2. Kết quả xổ số miền Bắc hôm nay thứ Ba ngày 3/2/2026.
-
![XSMT 3/2. Kết quả xổ số miền Trung hôm nay ngày 3/2/2026. XSMT thứ Ba ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSMT 3/2. Kết quả xổ số miền Trung hôm nay ngày 3/2/2026. XSMT thứ Ba ngày 3/2
21:34'
Bnews. XSMT 3/2. Kết quả xổ số hôm nay ngày 3/2. XSMT thứ Ba. Trực tiếp KQXSMT ngày 3/2. Kết quả xổ số miền Trung hôm nay thứ Ba ngày 3/2/2026.
-
![XSMN 3/2. Kết quả xổ số miền Nam hôm nay ngày 3/2/2026. XSMN thứ Ba ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSMN 3/2. Kết quả xổ số miền Nam hôm nay ngày 3/2/2026. XSMN thứ Ba ngày 3/2
21:33'
XSMN 3/2. KQXSMN 3/2/2026. Kết quả xổ số hôm nay ngày 3/2. XSMN thứ Ba. Xổ số miền Nam hôm nay 3/2/2026. Trực tiếp KQXSMN ngày 3/2. Kết quả xổ số miền Nam hôm nay thứ Ba ngày 3/2/2026.
-
![Về "địa chỉ đỏ" của phong trào công nhân đường sắt Nam Bộ]() Kinh tế & Xã hội
Kinh tế & Xã hội
Về "địa chỉ đỏ" của phong trào công nhân đường sắt Nam Bộ
20:32'
Nhà máy xe lửa Dĩ An không chỉ là một trong những cơ sở công nghiệp sớm nhất ở miền Nam còn duy trì hoạt động, mà còn là nơi ra đời chi bộ Đảng đầu tiên của Xứ ủy Nam Kỳ trong ngành đường sắt.
-
![Lịch sự kiện nổi bật tại Hội chợ Mùa Xuân 2026]() Kinh tế & Xã hội
Kinh tế & Xã hội
Lịch sự kiện nổi bật tại Hội chợ Mùa Xuân 2026
19:42'
Lịch sự kiện, lịch hoạt động nổi bật trong khuôn khổ Hội chợ Mùa Xuân 2026 diễn ra trong 12 ngày, từ ngày 2 đến ngày 13/2/2026 tại Trung tâm Triển lãm Việt Nam (Đông Anh, Hà Nội).
-
![Kết quả Vietlott Power 6/55 ngày 3/2 - Kết quả xổ số Vietlott ngày 3/2/2026 - Xổ số Vietlott Power 6/55 hôm nay]() Kinh tế & Xã hội
Kinh tế & Xã hội
Kết quả Vietlott Power 6/55 ngày 3/2 - Kết quả xổ số Vietlott ngày 3/2/2026 - Xổ số Vietlott Power 6/55 hôm nay
19:30'
Bnews. Kết quả Vietlott Power 6/55 ngày 3/2. Kết quả xổ số Vietlott hôm nay ngày 3 tháng 2 năm 2026 - Xổ số Vietlott Power 6/55 hôm nay.
-
![XSBT 3/2. Kết quả xổ số Bến Tre hôm nay ngày 3/2/2026. XSBT ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSBT 3/2. Kết quả xổ số Bến Tre hôm nay ngày 3/2/2026. XSBT ngày 3/2
19:00'
XSBT 3/2. Kết quả xổ số hôm nay ngày 3/2. XSBT Thứ Ba. Trực tiếp KQXSBT ngày 3/2. Kết quả xổ số Bến Tre hôm nay ngày 3/2/2026. Kết quả xổ số Bến Tre Thứ Ba ngày 3/2/2026. XSBTR hôm nay.
-
![XSBL 3/2. Kết quả xổ số Bạc Liêu hôm nay 3/2/2026. XSBL ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSBL 3/2. Kết quả xổ số Bạc Liêu hôm nay 3/2/2026. XSBL ngày 3/2
19:00'
Bnews. XSBL 3/2. Kết quả xổ số hôm nay ngày 3/2. XSBL Thứ Ba. Trực tiếp KQXSBL ngày 3/2. Kết quả xổ số Bạc Liêu hôm nay ngày 3/2/2026. Kết quả xổ số Bạc Liêu Thứ Ba ngày 3/2/2026.
-
![XSVT 3/2. Kết quả xổ số Vũng Tàu hôm nay ngày 3/2/2026. XSVT ngày 3/2]() Kinh tế & Xã hội
Kinh tế & Xã hội
XSVT 3/2. Kết quả xổ số Vũng Tàu hôm nay ngày 3/2/2026. XSVT ngày 3/2
19:00'
Bnews. XSVT 3/2. Kết quả xổ số hôm nay ngày 3/2. XSVT Thứ Ba. Trực tiếp KQXSVT ngày 3/2. Kết quả xổ số Vũng Tàu hôm nay ngày 3/2/2026. Kết quả xổ số Vũng Tàu Thứ Ba ngày 3/2/2026.



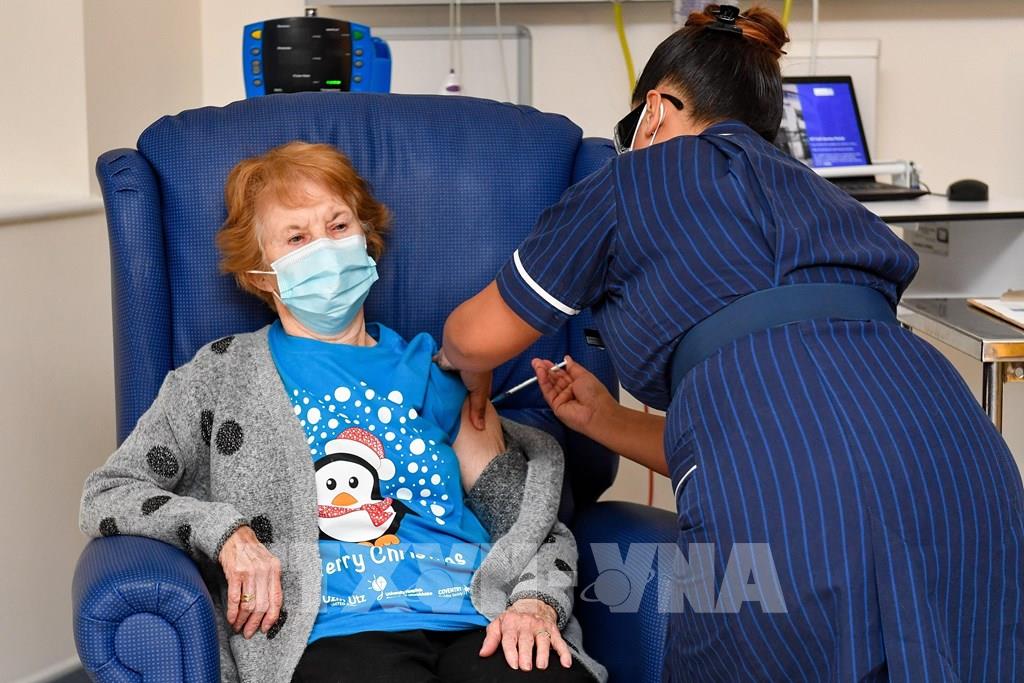 Nhân viên y tế tiêm vaccine ngừa COVID-19 của Pfizer/BioNTech cho cụ bà Margaret Keenan tại một bệnh viện địa phương ở Coventry, miền Trung vùng England ngày 8/12/2020. Ảnh: AFP/TTXVN
Nhân viên y tế tiêm vaccine ngừa COVID-19 của Pfizer/BioNTech cho cụ bà Margaret Keenan tại một bệnh viện địa phương ở Coventry, miền Trung vùng England ngày 8/12/2020. Ảnh: AFP/TTXVN